Tính chất hoá học ete
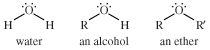
Ether , bất kỳ trong team hợp chất hữu cơ đặc trưng bởi nguyên tử oxy links với hai team alkyl hoặc aryl. Ete có cấu trúc tương từ như rượu , và cả ete với rượu phần nhiều có cấu trúc tương trường đoản cú như nước . Vào một rượu, một nguyên tử hydro của phân tử nước được sửa chữa bằng một đội nhóm alkyl, trong khi trong một ete, cả hai nguyên tử hydro được thay thế bằng team alkyl hoặc aryl.
Bạn đang xem: Tính chất hoá học ete
Ở ánh nắng mặt trời phòng, ete là hóa học lỏng ko màu, nặng mùi dễ chịu. Tương quan đến rượu, ete nói chung là ít đặc hơn, ít hài hòa trong nước với có nhiệt độ sôi thấp hơn . Chúng kha khá không vận động và vì chưng đó chúng tương đối hữu ích làm cho dung môi mang đến chất to , dầu, sáp , nước hoa , vật liệu nhựa , thuốc nhuộm , gôm cùng hydrocacbon. Hơi của ête nhất mực được thực hiện như dung dịch trừ sâu , miticides , với xông hơi cho đất.
Ete cũng tương đối quan trọng vào y học và dược học, đặc biệt là dùng làm thuốc gây mê . Ví dụ,ete etylic (CH 3 CH 2 ―O ― CH 2 CH 3 ), được gọi đơn giản dễ dàng là ete, lần thứ nhất được sử dụng làm thuốc gây nghiện phẫu thuật vào khoảng thời gian 1842.Codein , một bài thuốc giảm nhức mạnh, là metyl ete của morphin . Vì ete rất dễ dàng cháy, nó đang được chũm thế phần nhiều bằng các chất gây mê ít cháy hơn, bao hàm nitơ oxit (N 2 O) cùng halothane (CF 3 ―CHClBr).
Nhận quyền truy vấn độc quyền vào văn bản từ Phiên bản đầu tiên năm 1768 của cửa hàng chúng tôi với đăng ký của bạn. Đăng ký ngay hôm nay
Ete etylic là một dung môi tuyệt vời nhất để chiết xuất và mang đến nhiều nhiều loại phản ứng hóa học. Nó cũng rất được sử dụng làm hóa học lỏng khởi đụng dễ cất cánh hơi cho động cơ diesel và động cơ xăng khi tiết trời lạnh.Dimethyl ete được áp dụng làm chất đẩy xịt và chất làm lạnh. Methyl t -butyl ether (MTBE) là phụ gia xăng có công dụng tăng chỉ số octan và bớt lượng chất ô nhiễm và độc hại nitơ-oxit vào khí thải. Các ete của ethylene glycol được áp dụng làm dung môi và chất làm dẻo.
Danh pháp ete
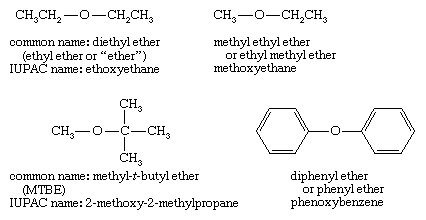
Tên thường thì của ete chỉ đơn giản và dễ dàng là mang đến tên của hai nhóm ankyl link với oxy cùng thêm tự ete . Thực tiễn hiện giờ là liệt kê những nhóm alkyl theo thiết bị tự bảng chữ cái ( t -butyl metyl ete), nhưng những tên cũ hơn hay liệt kê các nhóm ankyl theo vật dụng tự tăng ngày một nhiều về size (metyl t -butyl ete). Ví như chỉ một đội nhóm alkyl được thể hiện trong tên, nó ngụ ý hai nhóm giống nhau, như trong ete etylic so với ete dietyl.
Tên có khối hệ thống (IUPAC) đến ete sử dụng nhóm phức tạp hơn có tác dụng tên gốc, với nguyên tử oxy với nhóm bé dại hơn chọn cái tên là nhóm nỗ lực alkoxy. Các ví dụ được giới thiệu ở trên là ethoxyethane (dietyl ete), metoxyetan (metyl ete ete), 2-metoxy-2-metylpropan (MTBE) và phenoxybenzene (diphenyl ete). Danh pháp IUPAC vận động tốt cho các hợp chất có các nhóm chức bổ sung , vì các nhóm chức khác có thể được diễn đạt trong thương hiệu gốc.
Xem thêm: 3 'Chị Em' Nhà Mỹ Tâm, Đông Nhi, Khởi My 'Không Hẹn Mà Gặp'
Tính hóa học vật lý của ete
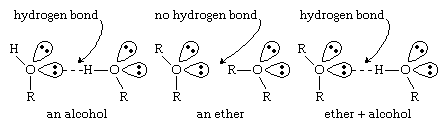
Các ete thiếu những nhóm hydroxyl của rượu . Nếu không có liên kết O ― H phân rất mạnh, những phân tử ete cấp thiết tham gia vàoliên kết hiđro với nhau. Mặc dù nhiên, ete có những cặp electron không link trên nguyên tử oxy và chúng hoàn toàn có thể tạo links hydro với các phân tử khác (rượu, amin , v.v.) có links O ― H hoặc N ― H. Tài năng tạo links hydro với những hợp chất khác tạo nên ete đặc trưng tốtdung môi đến nhiều loại hợp chất hữu cơ và một số trong những lượng bự đáng kinh ngạc các hợp hóa học vô cơ . (Để biết thêm thông tin về liên kết hydro, hãy coi liên kết hóa học: Lực giữa những phân tử .)
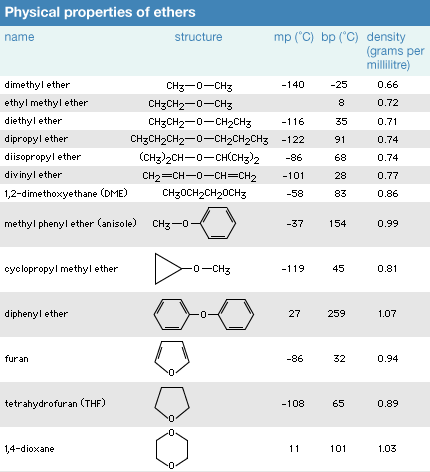
Phức hòa hợp của ete với thuốc thử
Các tính chất rất dị của ete (nghĩa là chúng phân rất mạnh, với những cặp electron không liên kết nhưng không có nhóm hydroxyl) làm tăng cường sự hiện ra và thực hiện nhiều dung dịch thử. Ví dụ,Thuốc demo Grignard cần yếu hình thành trừ khi gồm ete để chia sẻ cặp electron duy nhất của chính nó với nguyên tử magie . Sự tạo ra phức của nguyên tử magiê làm định hình thuốc demo Grignard với giúp duy trì nó vào dung dịch.
Thuốc thử thiếu thốn electron cũng được ổn định bởi ete. Ví dụ,borane (BH 3 ) là dung dịch thử có lợi để sinh sản rượu. Borane trong sáng tồn tại dưới dạng hóa học dimer, diborane (B 2 H 6 ), một nhiều loại khí độc gây phiền toái và nguy hại khi sử dụng. Mặc dù nhiên, borane chế tạo ra phức bền cùng với ete, cùng nó thường xuyên được cung ứng và áp dụng làm phức chất lỏng vớitetrahydrofuran (THF). Tương tự, khíbo triflorua (BF 3 ) dễ được sử dụng làm phức chất lỏng của nó với dietyl ete, được call là BF 3 etherat, hơn là khí độc, nạp năng lượng mòn.
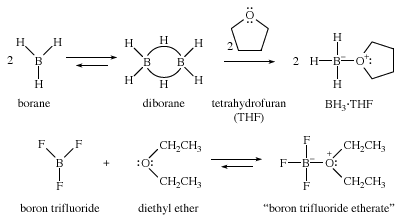
Crown ete là các polyette mạch vòng chuyên biệt bảo phủ các ion kim loại ví dụ để tạo thành các phức chất mạch vòng hình vương miện. Chúng được để tên bằng cách sử dụng vương miện của tên người mẹ trước một trong những mô tả kích cỡ của vòng với theo sau là số nguyên tử oxy trong vòng. Vào phức chất Crown-ete, ion kim loại nằm gọn trong vùng của ête và bị tổng hợp bởi các nguyên tử oxy. Bên ngoài của phức chất là không phân cực, được che bởi các nhóm alkyl của ete vương vãi miện. Nhiều muối vô cơ có thể được tạo ra hòa tan trong các dung môi hữu cơ không phân cực bằng phương pháp tạo phức bọn chúng với một ete vương vãi miện mê say hợp. Các ion kali (K + ) được tạo phức vày 18-Crown-6 (một vòng 18-mem cùng với 6 nguyên tử oxy), natriion (Na + ) bởi vì 15-Crown-5 (vòng 15-membered, 5 oxy), với ion liti (Li + ) bởi 12-crown-4 (vòng 12-mem, 4 oxy).
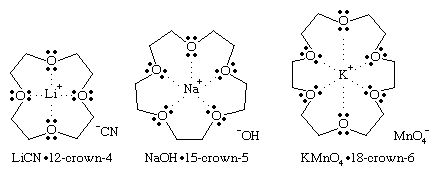
In each of these crown-ether complexes, only the cation is solvated by the crown ether. In a nonpolar solvent, the anion is not solvated but is dragged into solution by the cation. These “bare” anions in nonpolar solvents can be much more reactive than they are in polar solvents that solvate and shield the anion. For example, the 18-crown-6 complex of potassium permanganate, KMnO4, dissolves in benzene to lớn give “purple benzene,” with a bare MnO4− ion acting as a powerful oxidizing agent. Similarly, the bare −OH ion in sodium hydroxide (NaOH), made soluble in hexane (C6H14) by 15-crown-5, is a more powerful bazơ cùng nucleophile rộng nó lúc được tổ hợp bởi các dung môi phân cực như nước hoặc rượu.









